




《高中化学选修3分子的性质PPT课件下载》是由用户上传到老师板报网,本为文库资料,大小为1.8 MB,总共有52页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 52页
- 1.8 MB
- VIP模板
- ppt
- 数字产品不支持退货
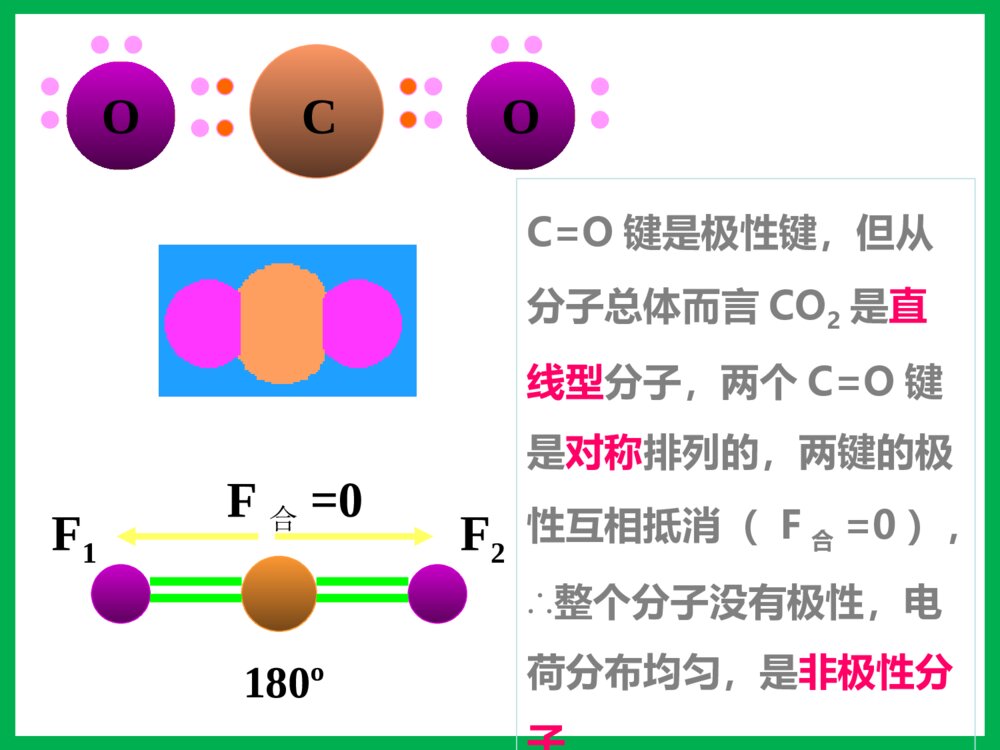
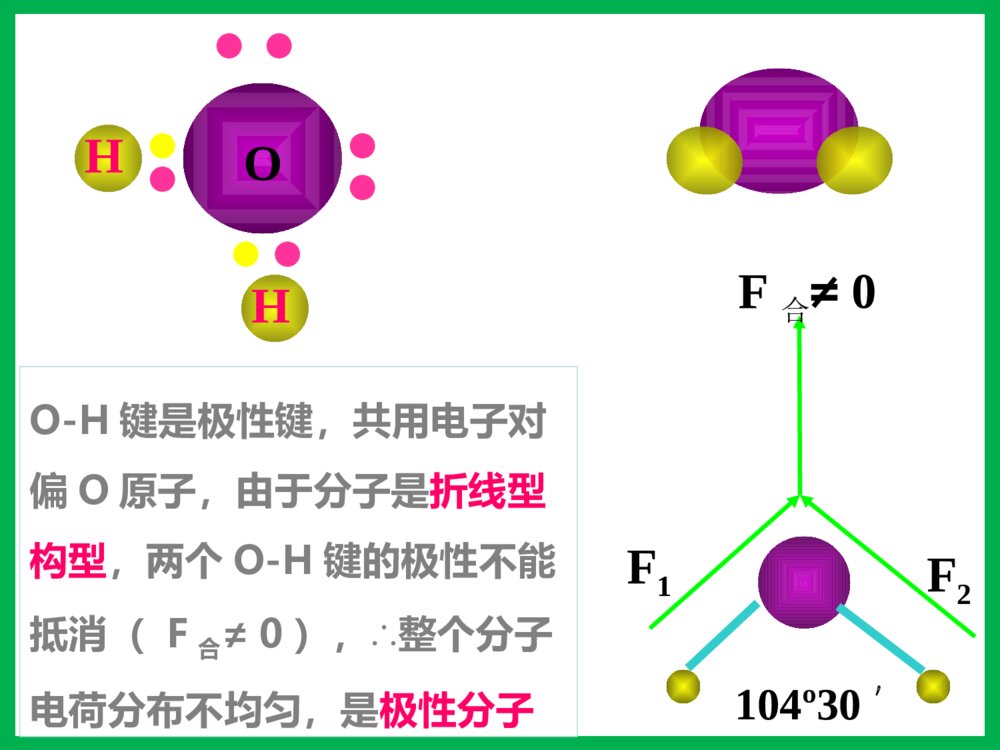
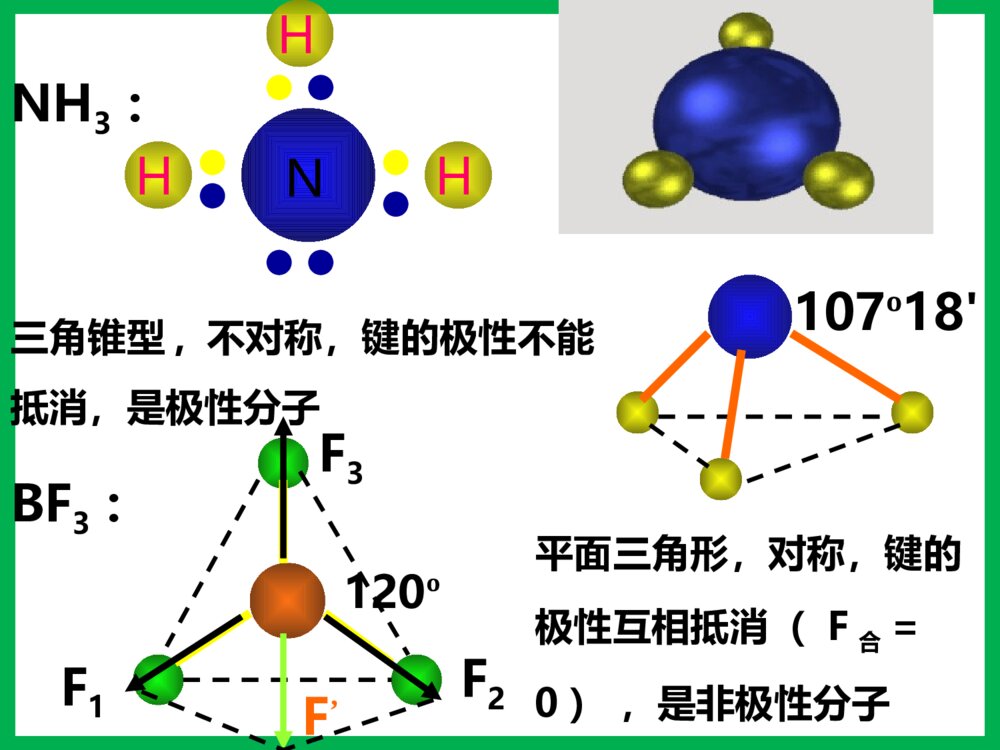
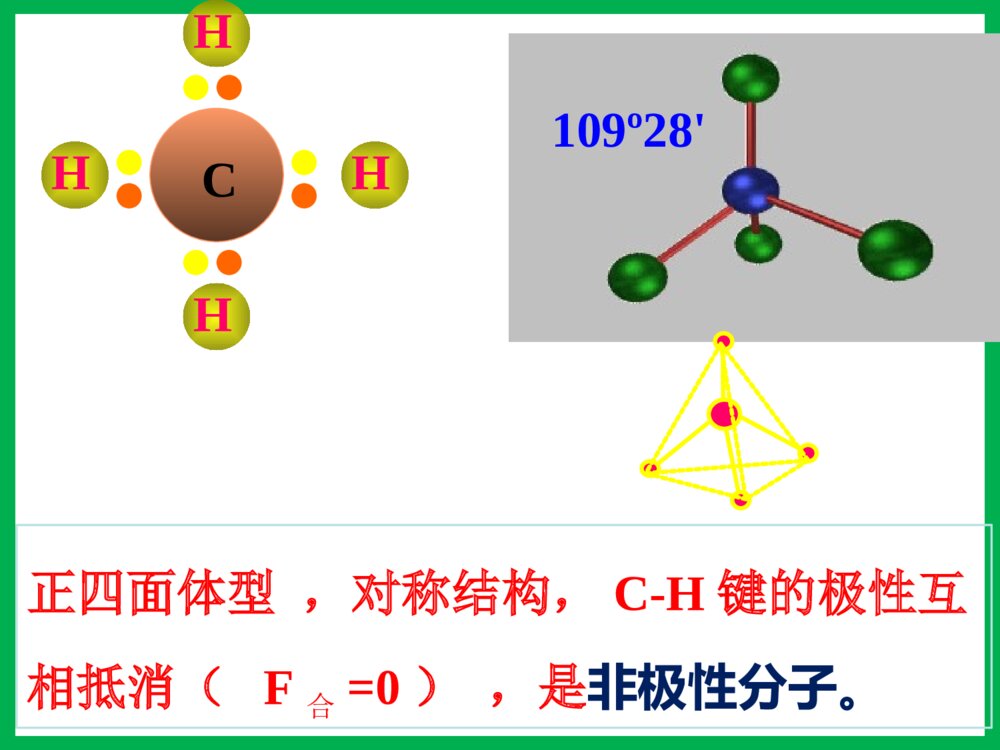
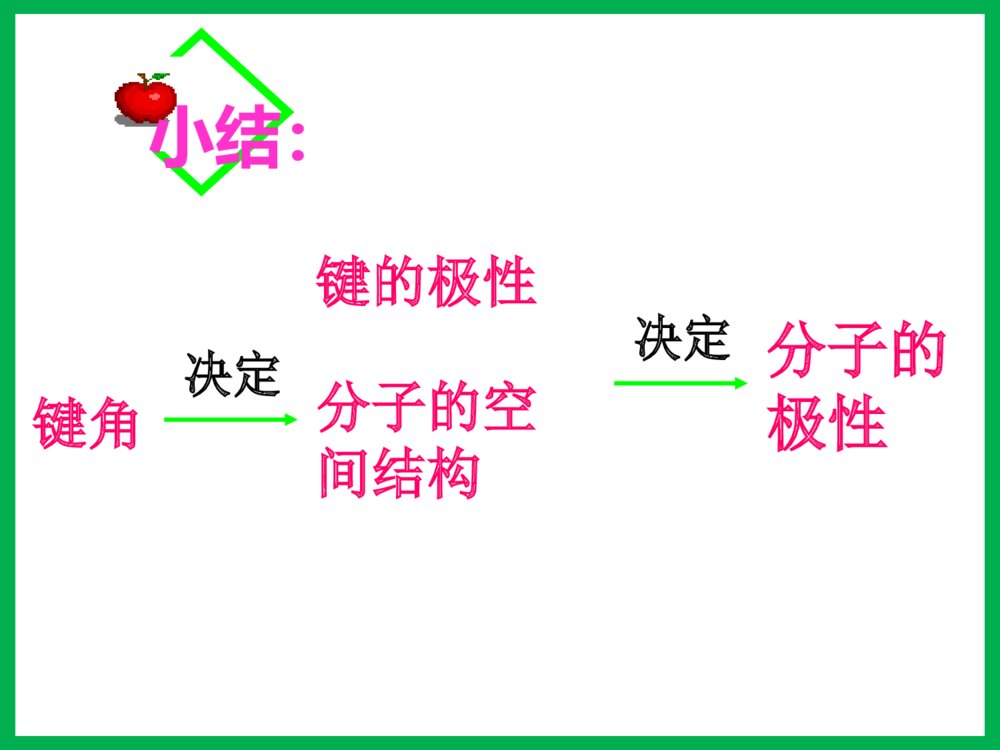
第三节分子的性质一、键的极性和分子的极性1、键的极性:2、分子的极性:极性分子正电荷重心和负电荷重心不相重合的分子非极性分子正电荷重心和负电荷重心相重合的分子(1)概念:由电负性决定(2)判断方法双原子分子多原子分子(ABm型)取决于分子的空间构型单原子分子取决于成键原子之间的共价键是否有极性化合物——极性分子单质——非极性分子——稀有气体非极性分子ABm分子极性的判断方法物理模型法将分子中的共价键看作作用力,不同的共价键看作不相等的作用力,运用物理上力的合成与分解,看中心原子受力是否平衡,如平衡则为非极性分子;否则为极性分子。C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消(F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180ºF1F2F合=0OOCHOH104º30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构型,两个O-H键的极性不能抵消(F合≠0),∴整个分子电荷分布不均匀,是极性分子HHHNBF3:NH3:120º107º18\'三角锥型,不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消(F合=0),是非极性分子CHHHH109º28\'正四面体型,对称结构,C-H键的极性互相抵消(F合=0),是非极性分子。分子的极性分子的空间结构键角决定键的极性决定小结:键的极性与分子极性的关系A、都是由非极性键构成的分子一般是非极性分子。B、极性键结合形成的双原子分子一定为极性分子。C、极性键结合形成的多原子分子,可能为非极性分子,也可能为极性分子。D、多原子分子的极性,应有键的极性和分子的空间构型共同来决定。【问题探究】冰山融化现象是物理变化还是化学变化?冰山融化过程中有没有破坏其中的化学键?那为什么冰山融化过程仍要吸收能量呢?分子间作用力分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力.常见的为范德华力和氢键范德华力的特点(1)广泛存在(由分子构成的物质)(2)作用力弱、是短程力(3)主要影响物质的物理性质(熔沸点)由分子构成的二、范德华力及其对物质性质的影响化学键范德华力概念存在范围作用力强弱影响的性质使原子相结合的相互作用把分子聚集在一起的作用力分子内、原子间分子之间较强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与范德华力的比较(1)范德华力大小范德华力很弱,约比化学键能小1-2数量级分子HClHBrHI范德华力(kJ/mol)21.1423.1126.00共价键键能(kJ/mol)431.8366298.7二、范德华力及其对物质性质的影响 (2)范德华力与相对分子质量的关系结构相似,相对分子质量越大,范德华力越大二、范德华力及其对物质性质的影响分子HClHBrHI相对分子质量36.581128范德华力(kJ/mol)21.1423.1126.00(3)范德华力与分子的极性的关系分子相对分子质量分子的极性范德华力(kJ/mol)CO28极性8.75Ar40非极性8.50相对分子质量相同或相近时,分子的极性越大,范德华力越大二、范德华力及其对物质性质的影响(4)范德华力对物质熔沸点的影响二、范德华力及其对物质性质的影响单质相对分子质量熔点/℃沸点/℃F238-219.6-188.1Cl271-101.0-34.6Br2160-7.258.8I2254113.5184.4【总结】一般情况下,组成和结构相似的分子,相对分子量越大,范德华力越大,熔沸点越高。三、氢键及其对物质性质的影响-100-50050100150H2OH2SH2SeH2Te沸点氢化物沸点(℃)H2O100.0H2S-60.75H2Se-41.5H2Te-1.3这表明在这表明在HH22OO分子之间除了存在分子之间除了存在vanderWaalsvanderWaals力外,力外,还存在另一种作用力。还存在另一种作用力。氢键及其形成条件1.定义:分子之间的氢核与带部分负电荷的非金属原子相互吸引,这种静电作用称氢键2.表示:X—H…Y(X、Y为N、O、F)HFHFHFHF3.氢键的形成条件:(1)在X—H…Y表示的氢键中,H原子位于X、Y间(2)X、Y所属元素具有很强的电负性,很小的原子半径,如N、O、F等。4.键参数:键长指X和Y的距离键能指X—H…Y分解为X—H和Y所需要的能量为什么冰会浮在水面上呢?5.特征:具有方向性,具有饱和性。氢键对物质性质的影响分子间氢键1.类型分子内氢键2、对性质的影响:熔沸点:(1)分子间氢键:升高(2)分子内氢键:降低溶解度:一般与溶剂形成分子间氢键可使溶解度升高,分子内则降低。ÁÚÏõ»ù±½·ÓÖеķÖ×ÓÄÚÇâ¼üNOOOH-150-125-100-75-50-2502550751002345××××CH4SiH4GeH4SnH4NH3PH3AsH3SbH3HFHClHBrHIH2OH2SH2SeH2Te沸点/℃周期一些化物的沸点CHOOHCHOOH熔沸点???用氢键的知识解释下列问题:(1)H2O的熔沸点为什么比硫化氢的高?(2)液态氟化氢的分子式为何可写成(HF)n?(3)为什么水和乙醇可以完全互溶?(4)为什么氨易液化?练习:1、下列分子中,不能形成氢键的是()A.NH3B.HFC.C2H5OHD.CH42.固体冰中不存在的作用力是()A.离子键B.极性键C.氢键D.范德华力3、假如水分子间没有氢键的结合,则水的沸点熔点()A.增大B.降低C.不变D.无法判断课堂练习下列事实与氢键有关的是()A.水加热到很高的温度都难以分解B.水结成冰体积膨胀,密度变小C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高D.HF、HCl、HBr、HI的热稳定性依次减弱B固体冰中不存在的作用力是()A.离子键B.极性键C.氢键D.范德华力课堂练习A下列关于范德华力影响物质性质的叙述中,正确的是( )A.范德华力是决定由分子构成物质熔、沸点高低的唯一因素B.范德华力与物质的性质没有必然的联系C.范德华力能够影响物质的化学性质和物理性质D.范德华力仅是影响物质部分物理性质的一种因素D四、溶解性为什么蔗糖和氨易容于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?思考:“相似相溶”原理:极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。(氢键可使溶解性增大)五、手性观察一下两组图片,有何特征?五、手性1、条件:Sp3杂化,连接四个不相同的原子或原子团2、特点:①具有完全相同的组成和原子排列②互为镜像,在三维空间里不能重叠手性合成五、手性乳酸分子CH3CH(OH)COOH有以下两种异构体:具有手性的有机物,是因为含有手性碳原子造成的。如果一个碳原子所联结的四个原子或原子团各不相同,那么该碳原子称为手性碳原子,记作﹡C。注意:也有一些手性物质没有手性碳原子五、手性指出下列无机含氧酸的酸性HClO4HClO3H2SO4HNO3H3PO4H2SO3H3BO3HNO2六、无机含氧酸分子的酸性已知酸性:H2SO4>H2SO3HNO3>HNO2HClO



















